코로나19 진단검사시약 수출용 허가 품목
뉴스1
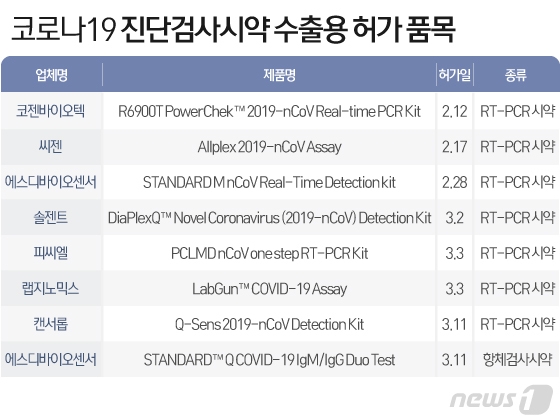
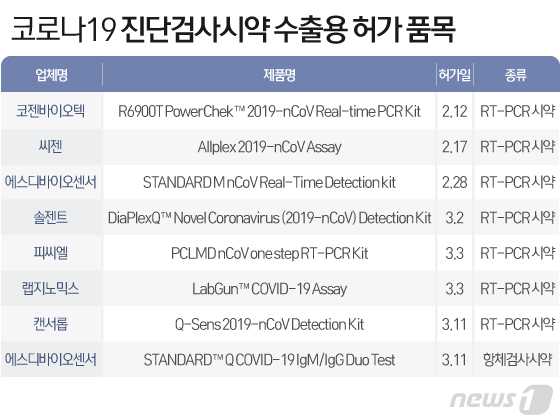
17일 뉴스1은 바이오업계를 인용해 코젠바이오텍과 씨젠, 솔젠트, 피씨엘 등 국내 업체들이 개발한 코로나19 유전자 검사 시약이 최근 식약처로부터 수출용 허가를 받고 해외진출 채비에 나섰다고 보도했다.
보도에 따르면 의약품이 수출되려면 먼저 이런 승인 과정을 밟아야 한다. 이후 각 수출국 허가당국의 규정에 따라 최종 승인을 받아야 정식으로 해당 국가 내 판매가 가능하다. 이번에 승인된 RT-PCR 시약 개발사는 국내서도 긴급사용승인을 받은 코젠바이오텍과 씨젠, 솔젠트, 에스디바이오센서를 포함해 피씨엘과 랩지노믹스, 캔서롭까지 7곳이다.
에스디바이오센서는 체내 항체 ‘IgM’과 ‘IgG’를 확인해 코로나19 감염여부를 확인하는 항체검사시약도 추가로 허가받았다. 통상적으로 진단시약의 수출용 허가는 내수용 허가와 달리 특별한 임상시험 없이 기술서류만으로도 승인을 받을 수 있다. 하지만 이번엔 임상적 성능도 검토된 것으로 알려졌다.
한국 업체들이 개발한 제품은 유전자분석장비인 RT-PCR을 통해 코로나19 확진여부를 확인하는 신속진단시약이다. 감염 의심자의 비강 안에서 채취한 가래나 침을 분석하면 6시간 내로 확진 여부을 확인할 수 있다. 기존의 검사법(판 코로나 검사)은 민간에서 사용할 수 없어 보건소나 병원에서 검체를 채취해 충북 오송에 위치한 질병관리본부로 이송하는 방식으로 이뤄졌다. 바이러스 결과가 나오기까지는 24시간 정도 걸렸다.
코로나19 팬데믹(세계 대유행) 현상이 짙어지면서 이들 수출 허가 기업들도 분주해지고 있다.
식약처와 질본은 감염병 위기 상황을 고려해 긴급사용 승인 여부를 지속해서 평가할 예정이다.
한편 이같은 소식에 관련 주가가 상승세를 보였다. 17일 오전 10시 현재 씨젠은 전일 대비 5.17% 오른 6만1000원을 기록 중이다. 수젠텍, 바이오니아, 엔지켐생명과학, 피씨엘, EDGC, 랩지노믹스 등이 모두 오름세다.
이보희 기자 boh2@seoul.co.kr






































