‘나파벨탄’… 고위험군 효과 입증
대규모 임상 3상 계획서도 제출
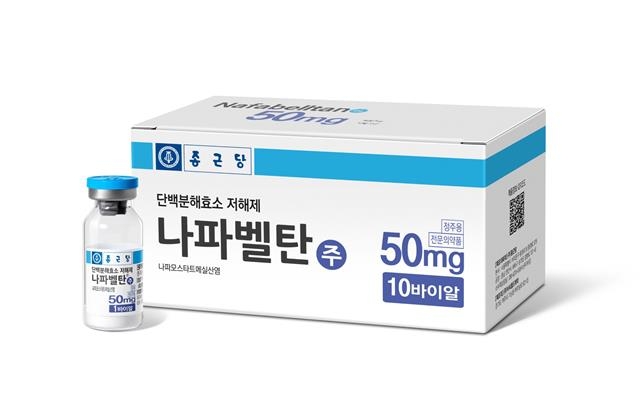
‘나파벨탄(성분명 나파모스타트)’
종근당이 중증의 고위험군 환자를 위한 코로나 치료제로 ‘나파벨탄(성분명 나파모스타트)’의 조건부 허가 및 임상 3상 승인을 식품의약품안전처에 신청했다고 8일 밝혔다. 나파벨탄은 급성 췌장염 치료제로 쓰이던 약이다.
종근당에 따르면 나파벨탄 투여군은 10일간 투여 직후 61.1%의 환자가 회복에 도달해 표준치료군(11.1%)에 비해 우월한 효과를 보였다. 전체 임상 기간인 28일이 지난 후에는 나파벨탄 투여군의 94.4%, 표준 치료군의 61.1%의 환자가 회복한 것으로 나타났다.
특히 코로나 증상 악화로 인한 사망 사례가 표준치료군에서 4건 발생한 데 비해, 나파벨탄 투약군에서는 발생하지 않았다.
종근당 관계자는 “나파벨탄은 중증의 고위험군 환자 대상 치료 효과가 입증된 유일한 약물”이라고 설명했다. 앞서 허가가 난 렉키로나주(성분명 레그단비맙)는 폐렴에 걸렸거나 연령이 50세 이상인 중등증 환자에게 효과가 있었다.
식약처는 제출된 비임상·임상자료 등을 검토하고 외부 전무가 자문을 거쳐 변경 허가 여부를 결정할 계획이라고 밝혔다. 식약처는 원래 6개월이 걸리는 허가 심사 기간을 코로나 치료제와 백신에 한해 40일 이내로 단축한다고 밝힌 바 있다. 앞서 렉키로나주의 승인까지는 35일이 걸렸다.
한편, 종근당은 조건부 허가 신청과 함께 대규모 임상 3상 시험 계획서도 제출했다. 임상 3상은 서울대병원 등에서 약 600명의 중증 고위험군 환자를 대상으로 진행할 예정이다.
명희진 기자 mhj46@seoul.co.kr
2021-03-09 21면
Copyright ⓒ 서울신문 All rights reserved. 무단 전재-재배포, AI 학습 및 활용 금지